.png)
Nieuw onderzoek ontdekt hoe neuronen sterven bij Alzheimer
Blootstelling aan amyloïde plaques en ophopingen van tau-eiwitten zet neuronen aan tot geprogrammeerde celdood
Leuven, 15 september 2023 – Wetenschappers onder leiding van Prof. Bart De Strooper (VIB-KU Leuven en UK Dementia Research Institute) en Dr. Sriram Balusu (VIB-KU Leuven) hebben ontdekt hoe neuronen afsterven bij de ziekte van Alzheimer. Dit baanbrekende onderzoek, gepubliceerd in het wetenschappelijk tijdschrift Science, toont dat neuronen gerpogrammeerd sterven na blootstelling aan amyloïde plaques en ophopingen van tau-eiwitten. Bovendien slaagde het onderzoeksteam erin het afsterven van neuronen te voorkomen, wat nieuwe mogelijkheden biedt voor toekomstige behandelingen.
De ziekte van Alzheimer is een veelvoorkomende vormen van dementie, verantwoordelijk voor 60 tot 70% van alle dementiediagnoses. Jaarlijks treft het zes tot zeven miljoen patiënten. Deze slopende ziekte brengt een grote emotionele en psychologische last met zich mee, zowel voor patiënten als hun families. Het is een groeiende maatschappelijke uitdaging en de Wereldgezondheidsorganisatie (WHO) bestempelt de ziekte dan ook als prioriteit voor de volksgezondheid. Hoewel er de voorbije jaren een aantal stappen vooruit werden gezet in het ontwikkelen van behandelingen die de voortgang van de ziekte vertragen, is er tot op vandaag geen hoop op genezing. De onderliggende oorzaak van de ziekte blijft tot op vandaag immers onvoldoende begrepen.
Een recente onderzoekspaper in het wetenschappelijk tijdschrift Science licht nu een tipje van de sluier. Prof. Bart De Strooper en Dr. Sriram Balusu onderzochten de biologische mechanismen die aan de basis van deze slopende ziekte liggen.
Prof. Bart De Strooper, groepsleider bij het VIB-KU Leuven Centrum voor Hersenonderzoek en verbonden aan het UK Dementia Research Institute, legt uit: “Ons onderzoek spitst zich toe op de tot nog toe troebele wateren van Alzheimer. We hebben een mogelijke sleutelspeler geïdentificeerd die verantwoordelijk is voor het verlies van neuronen – een RNA-gen genaamd MEG3 en het bijbehorende necroptose-proces. Onze bevindingen zijn een belangrijke stap voorwaarts in ons begrip van de fundamentele mechanismen achter deze complexe en vaak slecht begrepen ziekte.”
.png)
Een nieuw model om het Alzheimer mysterie te ontrafelen
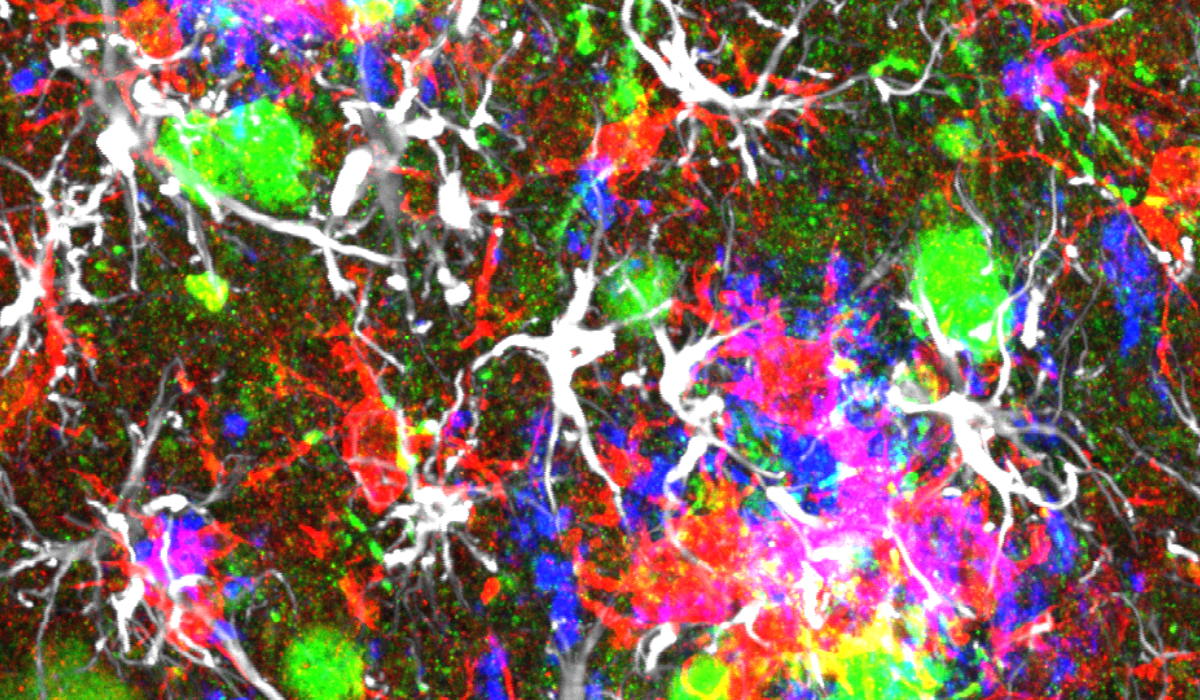
Een van de grootste uitdagingen bij het begrijpen van Alzheimer is het verband leggen tussen de karakteristieke kenmerken van de ziekte, zoals amyloïde plaques, tau-eiwitten en het afsterven van neuronen. Bestaande muismodellen die voor onderzoek worden gebruikt kunnen deze kenmerken niet natuurgetrouwnabootsen, waardoor onderzoekers met onbeantwoorde vragen bleven zitten over hoe die elementen verband hielden met het ziekteverloop.
“Om deze kloof te dichten, hebben we een nieuw model ontwikkeld,” zegt Sriram Balusu, postdoctoraal onderzoeker in het lab van Bart De Strooper en eerste auteur van de onderzoekspaper. “We hebben zowel gezonde menselijke neuronen als muizenneuronen ingebracht in het brein van Alzheimer-muismodellen. De menselijke neuronen degenereerden net als in het brein van patiënten met Alzheimer wat ons in staat stelde om het verouderingsproces van de hersenen te bestuderen en meer inzicht te krijgen in de processen die ten grondslag liggen aan Alzheimer.”
Opmerkelijk genoeg vertoonden alleen de menselijke neuronen, en niet hun knaagdiertegenhangers, kenmerken van Alzheimer die ook bij patiënten worden waargenomen, zoals ophopingen van tau-eiwitten en een aanzienlijk neuronverlies. Dit suggereert dat er bij Alzheimer mogelijks factoren aan het werk zijn die enkel bij mensen voorkomen en in standaard muismodellen niet kunnen worden nagebootst. Beter begrijpen waarom muizenneuronen beter bestand zijn tegen amyloïde pathologie, zal niet enkel bijdragen tot het beter modelleren van de ziekte, maar is mogelijks ook een stimulans voor onderzoek naar strategieën neurondegeneratie te voorkomen.
De boosdoener achter het neuronverlies
Met behulp van hun nieuwe model ging het team verder op zoek naar antwoorden over hoe neuronen bij Alzheimer afsterven. Het onderzoek leidde tot een cruciale doorbraak: in het model werd een geprogrammeerde vorm van celdood, die bekend staat als necroptose, geactiveerd. Dat leidde tot de dood van neuronen.
Maar de ontdekking ging nog verder. De onderzoekers zagen dat de aanwezigheid van een molecule genaamd MEG3 sterk verhoogd was in menselijke neuronen, net zoals bij Alzheimerpatiënten. De aanwezigheid van MEG3 alleen al zorgde ervoor dat de menselijke neuronen in een labsetting overgingen tot geprogrammeerde celdood. Het onderzoek toont ook aan dat door MEG3 te verminderen – en dus necroptose te vermijden – de onderzoekers erin slaagden om celdood te vermijden. Meer onderzoek is nodig om exact te begrijpen hoe MEG3 necroptose in gang zet, maar de ontdekking is een cruciale stap vooruit om te begrijpen hoe Alzheimer tot verlies van neuronen in de hersenen leidt.
“Necroptose is al een belangrijk onderzoeksgebied bij de ontwikkeling van geneesmiddelen voor kanker en ALS,” zegt Bart De Strooper. “Hoewel er nog veel meer te ontdekken valt, effenen onze bevindingen het pad voor potentiële behandelingen voor Alzheimer naast de meer traditionele strategieën die zich richten op amyloïde plaques en tau-ophopingen.”
Publicatie
MEG3 activates necroptosis in human neuron xenografts modeling Alzheimer's disease. Balusu et al. Science, 2023. DOI: 10.1126/science.abp9556
India Jane Wise
Vragen van patiënten
Een doorbraak in onderzoek betekent niet hetzelfde als een doorbraak in de geneeskunde. De verwezenlijkingen van VIB-onderzoekers kunnen de basis vormen voor nieuwe therapieën, maar het ontwikkelingstraject neemt nog jaren in beslag. Dit kan veel vragen oproepen. Daarom vragen we u om in uw reportage of artikel te verwijzen naar het e-mailadres dat VIB hiervoor ter beschikking stelt. Iedereen kan er met vragen omtrent dit en ander medisch gericht onderzoek terecht: patienteninfo@vib.be.
Over het VIB-KU Leuven Centrum voor Hersenonderzoek
Het VIB-KU Leuven Centrum voor Hersenonderzoek onderzoekt hoe hersencellen georganiseerd zijn en hoe ze met elkaar communiceren. Deze mechanismen blootleggen, geeft inzichten in wat er mis gaat bij hersenaandoeningen, zoals alzheimer, parkinson, ALS, en dystonie. Dit basiswerk moet uiteindelijk leiden tot nieuwe geneesmiddelen tegen deze ongeneeslijke aandoeningen.


